材料
• Spark Cyto 600 全自动实时活细胞成像检测系统,包含湿度盒 (Tecan)
• D300e 微量加样器 (Tecan)
• Real Time-Glo™ MT 细胞活力试剂盒(Promega)
• HeLa 细胞 (ATCC)
• Jurkat 细胞 (RIKEN BRC)
• Greiner 384 孔白色透明底聚苯乙烯细胞培养微孔板(cat #:781098)
• Greiner 384孔白色聚苯乙烯细胞培养微孔板(cat #:781075)
• 台盼蓝,二甲基亚砜
方法
• 设定Spark Cyto 细胞培养条件: 37 °C ,5 % CO2
• 将MT细胞活力底物、NanoLuc®酶和细胞培养基孵育至37℃
• 用台盼蓝染色HeLa或Jurkat细胞并计算活细胞数
• 将细胞悬浮液稀释至25或125个活细胞/l,并以40l/孔(1000或5000个细胞/孔)的浓度将其接种在384孔板中,在37℃的CO2培养箱中过夜
说明
• 通过单独的实验提前确定合适的细胞接种密度
• 细胞接种可以选择单通道或多通道手持加样器或自动化解决方案,如Tecan Fluent® 自动化工作站
• 空孔使用无菌水填充,减少样品蒸发
• 准备5X RealTime-Glo试剂用于在培养基中稀释MT细胞活力底物和NanoLuc 酶
• 每个孔中加入10l 5X Real Time-Glo试剂,并轻轻混合。
• 在37 °C和5% CO2的细胞培养箱中孵育30-60分钟。注:无菌水和小型湿度盒提前预热至37°C
• 使用D300e T8+分配盒移液溶解在DMSO中的化合物,剂量范围从0到1M,并使每个孔中DMSO的总体积归一化。注:快速移液以减小温度波动
• 在Spark Cyto中每1小时监测1次发光信号,持续24-48小时(详见实验方法)。注:若在检测过程中需要向湿度盒中添加无菌水,可提前优化实验方法。
• 导出数据并使用Python 3进行数据分析。注:数据分析可以选择Excel等其他软件

结果和讨论
通过明场成像24小时观察细胞汇合度,并使用预置的程序进行评估。化合物A给药24小时后,细胞汇合度受到抑制,并呈现剂量依赖性,表明化合物A抑制了细胞增殖(图1)。
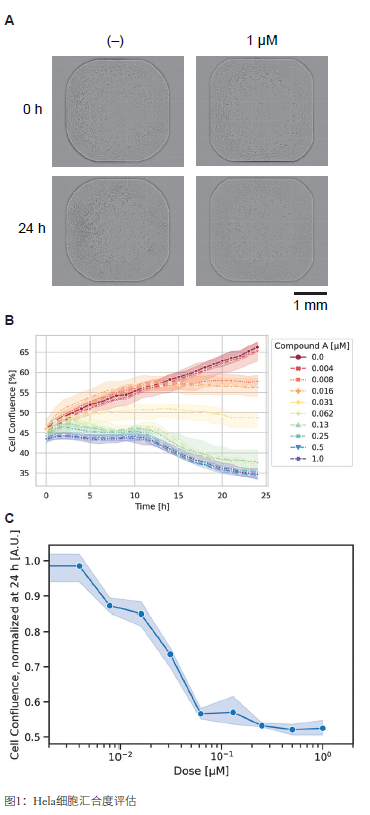
(A) 使用Spark Cyto获得的HeLa 细胞明场图像 (B) 细胞汇合度随时间的变化 (C) 化合物A给药24小时后的归一化值(N = 4,mean ± 95 % CI) 使用基于发光的方法检测细胞活力。在0小时的发光信号定义为阴性对照(图2A),24小时内呈现明显的剂量效应(图2B)。与图1的结果抑制,化合物A降低了细胞活力,并呈现剂量依赖性。Spark Cyto的细胞汇合度和细胞活力数据可用于评估药物疗效。

同时检测了悬浮细胞Jurkat的细胞活力,实验结果显示化合物B抑制了细胞增殖或诱导细胞死亡,并呈现剂量依赖性(图3)。

结论
D300e和Spark Cyto的成功联用,为药物对HeLa和Jurkat细胞的活力和生长的影响提供了综合数据,证明了该装置适用于贴壁或悬浮细胞的药物分析。两种不同检测方法的同时使用,突显出Spark Cyto在多重实验分析中的实力。
(文章来源:)
|